Drusen Çeşitleri ve Görüntülenme Yöntemleri
Drusen Çeşitleri ve Görüntülenme Yöntemleri
Drusen Types and Imaging Characteristics
* Uzman Doktor, İstanbul Retina Enstitüsü, İstanbul / ** Doçent Doktor, İstanbul Retina Enstitüsü, İstanbul / *** Profesör Doktor, İstanbul Retina Enstitüsü, İstanbul
ÖZET
Retina pigment epiteli altında ekstraselüler madde birikimleri drusen olarak tanımlanmaktadır. Drusen genelde yaşa bağlı makula dejenerasyonu ile olan ilişkisi bağlamında incelenmektedir. Bazı drusen çeşitleri yaşlanmanın normal bir sonucu olarak kabul edilmektedir, bazıları ise daha genç yaşlarda görülebilmektedir. Aynı zamanda bazı drusen tipleri farklı kalıtımsal ve sistemik hastalıklarla ilişkilendirilmektedir. Bu derlemede genelde normal yaşlanma sürecinin veya yaşa bağlı makula dejenerasyonun bir komponenti olan sert drusen, yumuşak drusen ve retiküler psödodrusen gibi drusen tiplerinin klinik ve görüntüleme bulgularının özetlenmesi amaçlanmıştır. Anahtar Kelimeler: Drusen, kuru tip, yaşa bağlı makula dejenerasyonu.
ABSTRACT
The formation of drusen in aging eye is characterized by accumulation of extracellular material underneath the retinal pigment epithelium. Usually drusen is evaluated in association with dry age related macular degeneration. Some types of drusen are recognised as normal consequence of aging, while some drusen types are associated with various inherited disorders and systemic conditions. The subtypes of clinically detectable deposit, seen usually in the context of ageing or age related macular degeneration, are described in detail, together with appearance on imaging modalities. Key Words: Drusen, nonexudative, age related macular degeneration.
GİRİŞ
Klasik olarak retina pigment epiteli (RPE) altında anormal ekstraselüler madde birikimlerine drusen adı verilmektedir. Drusen gelişimi normal yaşlanma sürecinin doğal bir sonucu olabielceği gibi, önemli bir retina hastalığın bulgusu da olabilir. [1] Bu ayrımın yapılabilmesi ise drusen özelliklerinin dikkatli bir şekilde değerlendirilmesine bağlıdır. Yaşlanma ile ilişkili biyokimyasal süreçler, değişikliğe uğramış genetik veya çevresel faktörler drusen oluşumuna ve hastalık gelişimine neden olmaktadır.
Erken evre yaşa bağlı makula dejenerasyonun (YBMD) patogenezi, lipid ve protein birikimine bağlı Bruch membranın kalınlaşması ile karakterizedir. Bu süreç RPE altında sert, yumuşak veya konfluent olarak tanımlanan farklı drusen oluşum- larına neden olmaktadır. Bruch membranındaki lipid birikimi RPE üzerinden gelen sıvı akışını engelleyerek RPE hücreleri üzerinde stres yaratmaktadır.[2] Bu ve benzeri stres faktörleri (sigara ve yaşlanmaya bağlı oksidatif stres) RPE hücrelerinde artmış lipofuscin birikimine neden olarak lizozomal fonksiyonları ve kolesterol metabolizmasını etkilemektedir.[3] Stres koşulları altındaki hücrelerde ekzozom gibi membran veziküllerin salınımının arttığı bilinmektedir.
Büyük olasılıkla bu süreç RPE altında drusen depozitlerin birikmesinden kısmi olarak sorumludur.[4] Ek olarak drusenin yapısında bulunan bazı proteinlerin, serum proteini olduğunu gösterilmesi, Bruch membranı düzeyinde olan sıvı akışındaki bozulmanın direk olarak drusen oluşumuna ve birikimine neden olabileceği öne sürülmektedir.[5]
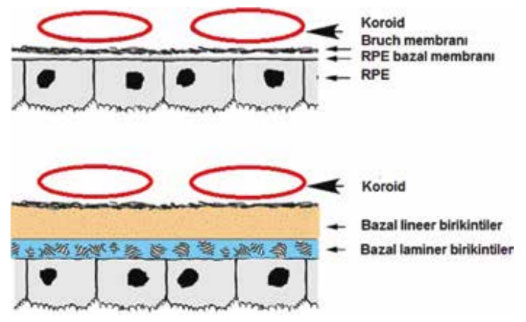 Resim 1. Sağlıklı retina (üst) ve erken evre yaşa bağlı makula dejenerasyonunda
(alt) koroid-retina pigment epiteli-retina arayüz özelliklerini yansıtan şematik
görünüm. Bazal laminer birikintiler, bazal lineer birikintiler ve drusen gibi erken
yaşa bağlı makula dejenerasyonu ile ilişkili lezyonlar bu arayüzde oluşmaktadır.
Resim 1. Sağlıklı retina (üst) ve erken evre yaşa bağlı makula dejenerasyonunda
(alt) koroid-retina pigment epiteli-retina arayüz özelliklerini yansıtan şematik
görünüm. Bazal laminer birikintiler, bazal lineer birikintiler ve drusen gibi erken
yaşa bağlı makula dejenerasyonu ile ilişkili lezyonlar bu arayüzde oluşmaktadır.
Retina pigment epiteli altındaki depozitler bazal laminer veya bazal lineer birikintiler şeklinde ayrılmaktadır (Resim 1). Bazal laminer depozitler RPE’nin plazma membranı ve bazal laminası arasında lokalize membranöz madde ve kolajen birikiminden meydana gelmektedir. Bazal lineer depozitler ise Bruch membranında iç kollajen katmanında veziküler madde birikimi ile karakterizedir. Bazal lineer birikintiler (0.4-2 μm) ve yumuşak drusen (30-300 μm) aynı özelliklere sahip, farklı boyutlarda olan oluşumlar olduğunu düşünülmektedir. Sert drusen ("<"63 μm), yumuşak drusen ile kıyasla daha yüksek apolipoprotein içeriğine sahiptir.[6] Yaşa bağlı makula dejenerasyonu ile ilişkilendirilmiş drusen tipleri arasında sert drusen, yumuşak drusen ve retiküler psödodrusen sayılmaktadır.[7]
Drusen boyutlarının artması ve pigment değişikliklerinin izlenmesi YBMD gelişim riskini arttırmaktadır. En son kabul gören klasifikasyona göre 55 yaş ve üzeri bireylerde küçük ("<"63 mm) drusen birikimlerin izlenmesi normal yaşlanma süreci olarak değerlendirilmektedir. Orta büyüklüğünde (63-125 μm) drusen ve pigmenter değişiklikler izlenmeyen olgular erken YBMD olarak incelenmektedir. Daha büyük (>125 μm) boyutlarda drusen ile birlikte pigment değişikliklerinin görülmesi ise orta evre YBMD şeklinde yorumlanmaktadır. Jeografik atrofive neovaskülarizasyon gelişimi ise ileri evre YBMD grubunda bulunmaktadır.[8]
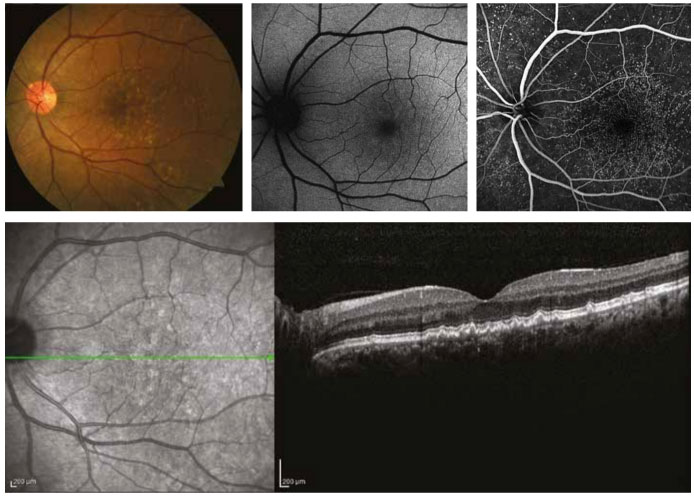
Resim 2. Altmış dokuz yaşında bayan hastanın renkli fundus görüntüsünde (üst sol) arka kutupta küçük ve orta boyda sert drusen birikintileri görülmektedir. Fundus otoflöresans incelemede (üst orta) belli belirsiz hipo ve izootoflöresan alanlar izlenmektedir. Erken faz flöresein anjiografide (üst sağ) “yıldızlı gökyüzu” görünümü dikkat çekmektedir. Horizontal foveal optik koherens tomografi kesitinde (alt) sert drusenin neden olduğu retina pigment epiteli düzensizliği testere dişi görüntüsü şeklinde dikkat çekmektedir.
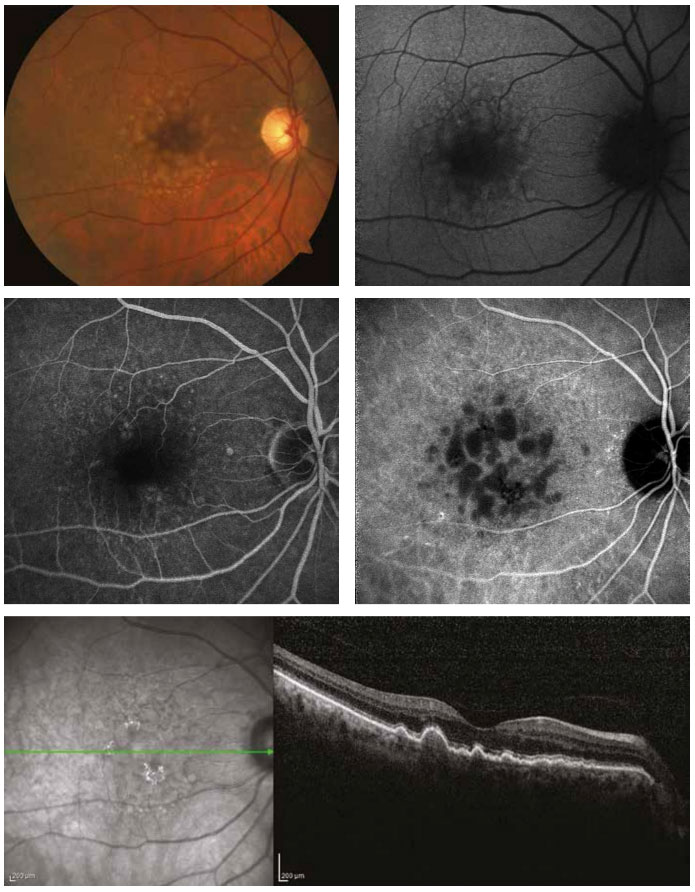
Resim 3. Kuru tip yaşa bağlı makula dejenerasyonu tanısı ile takip edilen 78 yaşında bayan hastanın fundus görüntüleri. Renkli fundus görüntüsünde (üst sol) farklı boyutlarda yumuşak drusen (küçük, orta, büyük) ve pigment değişikliği görülmektedir. Fundus otoflöresans incelemede (üst sağ) hafif hiperotoflöresan ve hipootoflöresan lezyonlar izlenmektedir. Orta-geç faz flöresein anjiografide (orta sol) yer yer hipo ve hiperflöresan alanlar görülse de, indosiyanin yeşili anjiografide (orta sağ) dusen birikintileri hipoflöresan olarak görülmektedir.Horizontal optik koherens tomografi kesitinde (alt) farklı drusen boyutlarina ait retina pigment epiteli düzensizlikleri dikkat çekmektedir.
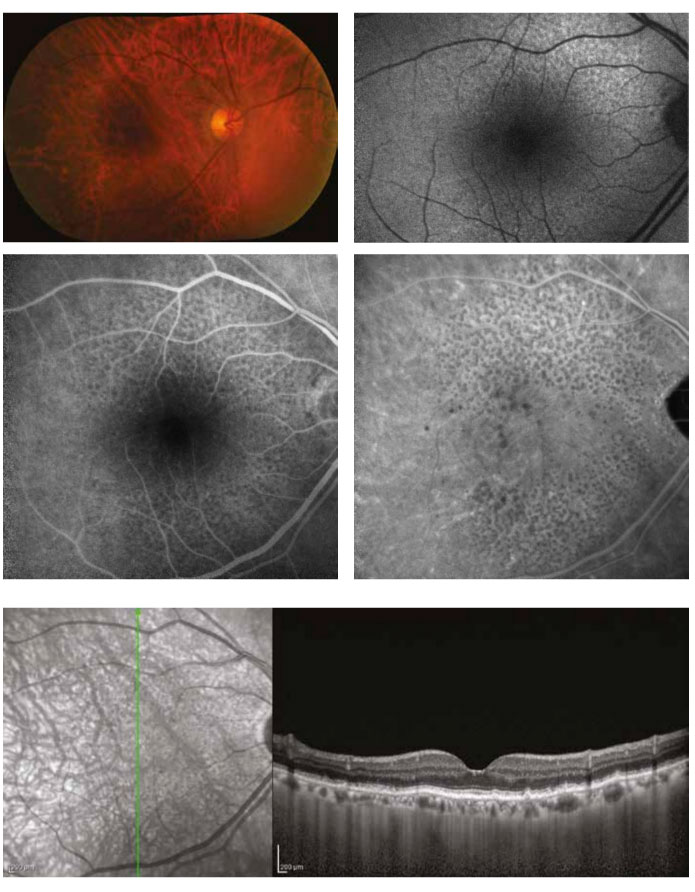
Resim 4. Kuru tip yaşa bağlı makula dejenerasyonu tanısı ile takip edilen 67 yaşında bayan hastanın fundus görüntüleri. Renkli fundus görüntüsünde (üst sol) foveada birkaç küçük drusen ve pigment değişikliği görülse de fovea dışında kalan makula alanlarında belli belisizi, soluk sarı renginde lezyonlar izlenebilmektedir. Fundus otoflöresans incelemede (üst sağ) makula üst nazal kısmında oldukça düzenli bir dağılım paterni gösteren hipootoflöresan lezyonlar görülmektedir. Orta-geç faz flöresein anjiografi (orta sol) ve indosiyanin yeşili anjiografi (orta sağ) tetkiklerinde fovea dışında kalan makula alanlarında belirgin hipoflöresan noktalar dikkat çekmektedir. Vertikal optik koherens tomografi kesitinde (alt) sert drusenin neden olduğu RPE düzensizliği ve bunun üzerinde yerleşmiş retiküler psödodrusen görülmektedir.
SERT DRUSEN
Sert drusen, renkli fundus fotoğraflarında küçük ("<"63 μm), iyi sınırlı, sarı-beyaz görünümünde birikintiler olarak görün- tülenmektedir.[9] Sert drusenin prevalansı 43-86 yaş aralığında %94 oranında bildirilmektedir. Yaşa bağlı makula dejenerasyonu olgularında sert drusen depozitleri bulunsa da, bu drusen çeşidi normal yaşlanmanın bir sonucu olarak meydana geldiğini düşünülen tek drusenoid birikimdir.[10]
Geniş açı renkli fundus görüntüleme tüm retina alanların- da sert drusen birikimlerinin saptanması için son derece kullanışlıdır. Sert drusen santral ve periferal (damar arkadlarının dışında) retina alanlarda lokalize olabilmektedir ve küçük boyutlarına rağmen diğer drusen tipleri ile kıyasla daha kolay ayırt edilmektedir (Resim 2). Sert drusen için karakteristik sayılabilecek fundus otoflöresans (FOF) bulguları arasında bazen hiperotoflöresan halka ile çevrelenmiş hipootoflöresan odaklar şeklinde özetlenebilir. Farklı drusen tiplerinin sınıflandırılmasında optik koherens tomografi (OCT) tekniği etkin bir şekilde kullanılsa da, sert drusenin özelleklerini bildiren nispetten az yayına rastlanmaktadır.[11] Optik koherens tomografi kesitlerinde sert drusen birikimleri RPE altında lokalize, küçük, hiperreflektif birikintiler şeklinde görüntülense de bazen bu oluşumlar renkli fundus görüntüsü ile kıyaslandığında daha zor fark edilmektedir.[12] Sert drusen, erken faz flöresein anjiografi (FA) ve indosiyanin yeşili anjiografi (İSYA) tetkiklerinde hiperflöresan görünümdedir. İlerleyen fazlarda FA tetkikinde flöresansta azalma görülse de, İSYA’da hiperflöresan görünüm devam eder.[13] Flöreseinin bağlanması drusenin boyutundan ziyade biyokimyasal içeriği ile ilişkilidir. Daha yuksek fosfolipid içeriğine sahip birikintiler daha fazla flöresein bağlarken, yüksek oranda nötral lipid içeren birikintiler daha az miktarda flöresein bağlamaktadır.[14]
YUMUŞAK DRUSEN
Yumuşak drusen sarı-beyaz renkte, genelde ≥125 μm çapında, sınırları silik lezyonlar şeklinde tanımlanmaktadır. Genelde arka kutupta yerleşim göstermektedir (santral makula, superior ve temporal kadranlar) (Resim 3). Sarımsı görünüme sahip olsa da merkezi daha beyazımsı olabilmektedir.[15] Yumuşak drusen RPE ve fororeseptör kaynaklı artıkların Bruch membranında birikmesıyle medana gelmektedir.[16]
Lizozomal kaynaklı olan, yaşlı hücrelerde birikim gösteren ve fundus otoflöresansın ana kaynağı olan lipofuscin, YBMD olgularında hızla ve çok fazla artmaktadır. Fundus otoflöresans görüntüleme ile değişen otoflöreansın seviyesine göre lipofuscin yükü ve dolaylı yoldan oksidatif stres ile ilgili fikir sahibi olunmaktadır.[17] Daha büyük çaptaki yumuşak drusen birikintilerinde daha heterojen FOF sinyali dikkat çekse de, daha küçük buyutlardaki yumuşak drusen için genelde hiperotoflöresan halka ile çevreli merkezi hipootoflöresans karak- teristiktir.[18] Optik koherens tomografi kesitlerinde yumuşak drusen depozitleri RPE düzeyinde farklı boyutlarda, kubbe şeklinde elevasyonlar olarak dikkat çekmektedir. Optik koherens tomografi incelemelerinde tespit edilen drusen kalınlığı ve renkli fundus görüntülemede izlenen drusen rengi arasında ilişki bulunamamıştır.[19] Drusen çapının belirlenmesinde her iki görüntüleme tekniği de etkin bulunmuştur. Daha küçük yumuşak drusen birikintiler için renkli fundus görüntüleme daha hassas olsa da, OCT kesitlerinde büyük drusen birikintilerin sınırları daha doğru bir şekilde belirlenmektedir.[20] Yumuşak drusenin İSYA görüntüsü bütün fazlarda hipoflöresan iken FA’nin geç fazlarıda hafif hiperflöresan lezyonlar şeklinde görüntülenmektedir.[21]
RETİKÜLER PSÖDODRUSEN
Retiküler psödodrusen bir drusen alt tipi olarak kabul edilmekte ve YBMD’de kötü prognoz ile ilişkilendirilmektedir. Sensöryel retina ve RPE arasında lokalize olan retiküler psödodrusen birikintileri genelde diğer drusen çeşitleri ile birlik- te bulunmaktadır. Retiküler psödodrusen ilk kez 1990 yılında Mimoun ve ark. tarafından mavi reflektans fundus fotoğrafı ile tespit edilebilen lezyonlar şeklinde tanımlanmıştır.[22] Retiküler psödodrusen, renkli fundus görüntülemede yumuşak drusen ile kıyasla daha soluk sarı renkte, noktasal, düzensiz sinüsoidal veya halka şeklinde, 125-250 μm çapında lezyonlar veya birbirine girmiş ağlar şeklinde izlenmektedir. Genelde fovea ala- nında lokalize olan yumuşak drusenden farklı olarak, daha çok fovea dışında, makulanın üst temporal kısmında görülmektedir.[23] Söz konusu lezyonlara genelde retina pigment değişikliği bulguları eşlik etmemektedir ve geniş retina alanları üzerinde oldukça üniform bir patern görünür. Arnold ve ark. retiküler psödodrusenin bazal laminer veya bazal lineer depozit birikimi ile ilişkili olmadığını ve retiküler paternin koroidin lobuler anatomisi ile ilişkili olduğunu iddia etmiştir. Sonuç olarak söz konusu patolojinin primer olarak koroid hastalığı olduğunu, koroidal damarlarda incelme ve retiküler fibrozis eşlik ettiğini öne sürülmüş ve ‘’retiküler psödodrusen’’ terimi önerilmiştir. [24] Daha güncel çalışmalar retiküler psödodrusenin patolojisı subretinal alanda madde birikimi ile ilişkili olduğunu bildirmektedir.[25]
Retiküler psödodrusen lezyonların tespitinde infrared reflektans görüntülemenin (815 nm), renkli fundus görüntülemeile kıyasandığında daha duyarlı bir görüntüleme yöntemi olduğu gösterilmiştir.[26] Yapılan çalışmalarda retiküler psödodrusen birikintilerin tespitinde, infrared reflektans görüntülemenin duyarlılığı %95 oranında olduğunu bildirilmiştir.[27] Yakıninfrared reflektans (790 nm) incelemede retiküler psödodruseniçin orta hiperreflektan zemin üzerinde hiporeflektan lezyonların görülmesi karakteristiktir (Resim 4). Söz konusu lezyonlarFOF veya yakın infrared reflektans ile foveada görüntülenebilmektedir. Retiküler psödodruseni ayıran ve söz konusu lezyoniçin oldukça belirgin bir bulgu olan ‘’hedef lezyon’’ tanımı,hiporeflektif halka ile çevreli izoreflektif merkez şeklinde tarifedilmektedir.[28] Fundus otoflöresans görüntüleme retikülerpsödodrusenin tespitinde renkli fundus görüntülemeden dahaduyarlıdır. Fundus otoflöresans görüntülemede dikkat çekenretiküler hipootoflöresan patern, retiküler psödodrusen içinson derece karakteristiktir. Retiküler psödodrusen görünümüartmış otoflöresan zeminde çoklu, noktasal hipootoflöresanodaklar ile karakterizedir ve infrared görüntülemede izlenenhiporeflektif alanlara uymaktadır.[29] Querques ve ark. SD-OCT ile retiküler psödosrusen örnekleri üzerinde yaptıkları çalışma sonrasında klasifikasyon sistemi geliştirmiştir: RPE ve içsegment-dış segment bandı (IS/OS) arasında granüler maddebirikimi evre 1, İS/OS bandında kontür değişikliğine nedenolan madde birikimi evre 2, artmış madde birikimi ve İS/OSbandında bozulma evre 3 ve rezorpsiyon veya iç retinal katmanlara migrasyon nedeniyle sebretinal maddenin azalmasıevre 4 olarak tanımlanmıştır.[30] SD-OCT kesitlerinde, retiküler psödodrusen birikimlerin altındaki koroid tabakasındaışık şeritleri olarak tarif edilen bulgular görülebilmektedir. Sözkonusu şeritler bazı alanlarda artmış olan kızıl ötesi işiğın penetrasyonu ile ilişkilidir. Bu fenomenin retiküler psödodrusenboyutu ile ilişkili olmadığını ve OCT kesitlerinde RPE düzeyinde değişiklik olmadığını bildirilmiştir.[31] Flöresein anjiografi, retiküler psödodrusen lezyonların değerlendrilmesindeher zaman iyi bir görüntüleme sağlamasa da, orta-geç İSYAçekimlerinde belirgin, hipoflöresan noktalar şeklinde lezyonlarizlenmektedir.[32]
DRUSENOİD PİGMENT EPİTELİ DEKOLMANI
Drusenoid pigment epiteli dekolmanı (PED) birkaç büyükyumuşak drusen veya yaygın birleşik drusenden oluşan, çapı500 mikrondan büyük, sınırları belirgin ve soluk sarıdan beyaza kadar değişen renklerde RPE elevasyonlarıdır (Resim 5).Fundus otoflöresans görüntülemede hafif hiperotoflöresandır,pigment birikintileri olan bölgelerde hipootoflöresans gösterebilir. Flöresein anjiografide erken fazda hafif bir hiperflöresansbaşlar, giderek flöresans artar, ancak sızıntı olmaz. İndosiyaninyeşili anjiografide tüm fazlarda hipoflöresandır. Optik koherens tomografide RPE kontüründe kubbe şeklinde kabarıklıkgörülür, içerisinde solid materyal ve kısmen sıvı bulunabilir,ancak altında gölgelenme olmaz veya çok hafiftir. DrusenoidPED üzerindeki retina pigment epiteli bozulduğunda gerilemeye başlar ve zamanla kollabe olarak yerini atrofik bir lezyonabırakmaktadır.
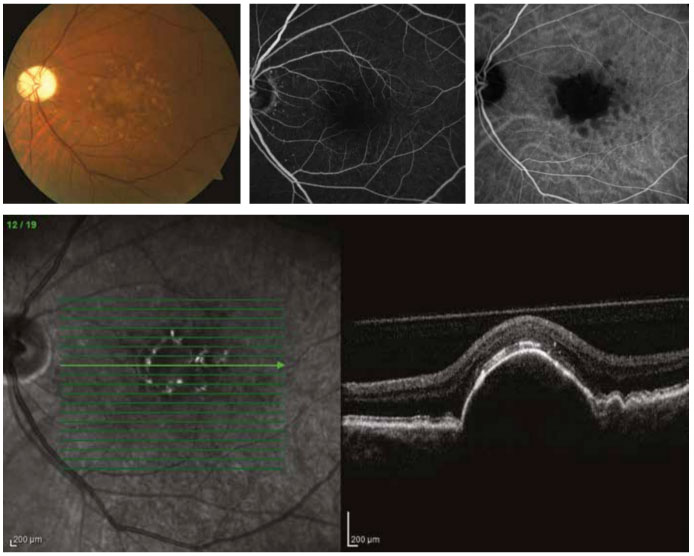
Resim 5. Kuru tip yaşa bağlı makula dejenerasyonu tanısı ile takip edilen 77 yaşında bayan hastanın fundus görüntüleri. Renkli fundus görüntüsünde (üst sol) foveada bir optik disk çapından büyük, soluk sarı renginde drusenoid pigment epiteli dekolmanı ve çevresinde farklı boyutlarda yumuşak drusen ve pigment değişikliği görülmektedir. Erken-orta faz flöresein anjiografide (üst orta) foveada hafif bir hiperflöresans izlense de, indosiyanin yeşili anjiografide (üst sağ) sınırları belirgin hipoflöresan alan olarak görülmektedir. Horizontal optik koherens tomografi kesitinde (alt) retina pigment epiteli kontüründe ileri düzeyde elevasyon dikkat çekmektedir.
YUMUŞAK DRUSEN ÇEŞİTLERİ
Sert drusen birikintilerinin sıkı kümeler oluşturarak tek birtabaka gibi göründüğünde yumuşak drusen şeklinde değerlendirilebilir (yalancı yumuşak drusen). Fakat FA tetkikindeküçük drusen kümeleri kolayca ayırt edilmektedir. Gerçekyumuşak drusen ise kendi içinde yumuşak granüler drusen,yumuşak membranöz drusen ve yumuşak seröz drusen şeklinde ayrılabilir. Klinik olarak yumuşak granüler drusen 250 mikron civarında, sarı, solid sinuzoid şeklinde görülmektedir. ve histolojik olarak granüler yapıya sahiptir (Resim 6). Yumu- şak membranöz drusen sarı granüler drusene ile kıyasla daha soluk ve daha az kabarıktır (Resim 7). Flöresein anjiografide küçük sert drusenden daha geç ve daha az parlak floresans ver- mektedir. Orta ve ileri evre YBMD için spesifiktir. Yumuşak seröz drusen ise 250-500 mikronun üzerinde yumuşak birleşik drusen içinde RPE pompasının bozulmasıyla seröz sıvının göl- lenmesiyle oluşmaktadır (Resim 8). Üzerindeki RPE bozuldu- ğunda drusen geriler, beyaz ve sert bir hal alır (gerileyen veya solan drusen). Kenarları düzensizleşir, kalsifikasyon odakları oluşur ve sonunda RPE atrofisi gelişir.
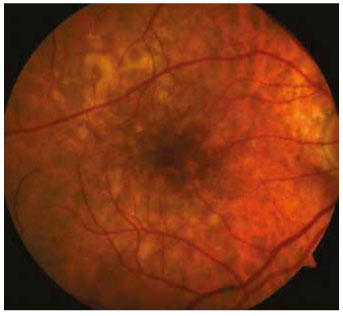
Resim 6. Yumuşak granüler drusen.
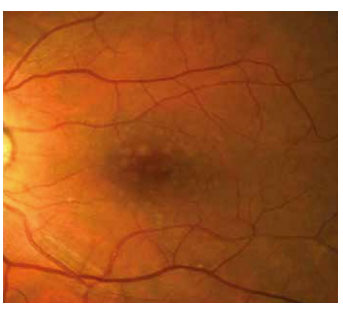
Resim 7. Yumuşak membranöz drusen.
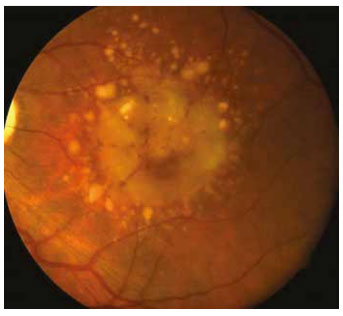
Resim 8. Yumuşak seröz drusen ve drusenoid pigment epiteli dekolmanı.
SONUÇ
Günümüzde yaş tip YBMD tedavi edilebilir bir hastalık olarak kabul edilmektedir. Artık hedefler hastalığın daha erken evrede tedavisine yönelmiştir ve dikkatler drusen üzerine çekilmeye başlamıştır. Drusen gelişimini engelleyen tedavilerin gelişimi bir hedef olabilir. Fakat drusen gelişimi altta yatan birpatolojik sürecin sonucu olduğundan, tek başına drusen gelişimini engellemek yeterli sonuç veremeyebilir. Bruch membranıdüzeyinde izlenen diffüz kalınlaşma daha önemli bir faktör gibigörülmekte ve söz konusu yapı üzerinden madde geçişini sağlayan stratejilerin geliştirilmesi umut verici olabilir. Moleküerve genetik düzeyde ve çevresel faktörler ile ilgili bilgilerin artması, hastalık gelişimini engelleyen yaklaşımların ortaya çıkmasını sağlayacaktır.
REFERANSLAR
1. Ardeljan D, Chan CC. Aging is not a disease: distinguishing age-related macular degeneration from aging. Prog Retin Eye Res. 2013;37:68-89.
2. Curcio CA, Johnson M. Structure, Function, and Pathology of Bruch’s Membrane. London: Elsevier, Inc.; 2013.
3. Miller JW. Age-related macular degeneration revisited–piecing the puzzle: the LXIX Edward Jackson memorial lecture. Am J Ophthalmol. 2013;155:1–35.
4. Wang AL, Lukas TJ, Yuan M, Du N, Tso MO, Neufeld AH. Autophagy and exosomes in the aged retinal pigment epithelium: possible relevance to drusen formation and agerelated macular degeneration. PLoS One. 2009;4:4160.
5. Wang L, Clark ME, Crossman DK, Kojima K, Messinger JD, Mobley JA, Curcio CA. Abundant lipid and protein components of drusen. PLoS One 2010;23;5(4):10329.
6. Rudolf M, Clark ME, Chimento MF, Li CM, Medeiros NE, Curcio CA. Prevalence and morphology of druse types in the macula and periphery of eyes with age-related maculopathy. Invest Ophthalmol Vis Sci 2008;49:1200–1209.
7. Mimoun G, Soubrane G, Coscas G. Macular drusen. J Fr Ophthalmol 1990; 13:511–30.
8. Ferris FL 3rd, Wilkinson CP, Bird A, Chakravarthy U, Chew E, Csaky K, Sadda SR; Beckman Initiative for Macular Research Classification Committee. Clinical classification of age-related macular degeneration. Ophthalmology 2013;120(4):844-51.
9. Age-Related Eye Disease Study Research Group.The age-related eye disease study (AREDS) system for classifying cataracts from photographs: AREDS report no. 4. Am J Ophthalmol 2001;131(2):167-75.
10. Rudolf M, Clark ME, Chimento MF, Li CM, Medeiros NE, Curcio CA. Prevalence and morphology of druse types in the macula and periphery of eyes with age-related maculopathy. Invest Ophthalmol Vis Sci 2008;49(3):1200-9.
11. Khan KN, Mahroo OA, Khan RS, et al. Differentiating drusen: Drusen and drusen-like appearances associated with ageing, age-related macular degeneration, inherited eye disease and other pathological processes. Prog Retin Eye Res 2016;53:70-106.
12. Khanifar AA, Koreishi AF, Izatt JA, Toth CA.Drusen ultrastructure imaging with spectral domain optical coherence tomography in age-related macular degeneration. Ophthalmology 2008;115(11):1883-90.
13. Arnold JJ, Fraco MQ, Soubrane G, Sarks SH, Coscas G. Indocyanine green angiography of drusen. Am J Ophthalmol 1997; 124:344–56.
14. Pauleikhoff D, Zuels S, Sheraidah GS, Marshall J, Wessing A, Bird AC. Correlation between biochemical composition and fluorescein binding of deposits in Bruch’s membrane. Ophthalmology 1992;99(10):1548-53.
15. Bird AC, Bressler NM, Bressler SB, Chisholm IH et al. An international classification and grading system for age-related maculopathy and age-related macular degeneration. Surv Ophthalmol 1995; 39:367–74.
16.Sarks JP, Sarks SH, Killingsworth MC. Evolution of soft drusen in age-related macular degeneration. Eye 1994; 8:269–83.
17. Spaide RF. Fundus autofluorescence and age-related macular degeneration. Ophthalmology 2003; 110:392–9.
18. Delori FC, Fleckner MR, Goger DG, Weiter JJ, Dorey CK. Autofluorescence distribution associated with drusen in agerelated macular degeneration. Invest Ophthalmol Vis Sci 2000; 41:496–504.
19. Spaide RF, Curcio CA. Drusen characterization with multimodal imaging. Retina 2010;30(9):1441-54.
20. Jain N, Farsiu S, Khanifar AA, Bearelly S, Smith RT, Izatt JA, Toth CA.
Quantitative comparison of drusen segmented on sd-oct versus drusen delineated on color fundus photographs. Invest Ophthalmol Vis Sci 2010; 51: 4875–83.
21. Arnold JJ, Fraco MQ, Soubrane G, Sarks SH, Coscas G. Indocyanine green angiography of drusen. Am J Ophthalmol 1997; 124:344–56.
22. Mimoun G, Soubrane G, Coscas G. Macular drusen. J Fr Ophtalmol 1990;13(10):511-30.
23. Davis MD, Gangnon RE, Lee LY et al. The Age-Related Eye Disease Study severity scale for age-related macular degeneration: AREEDS report no. 17. Arch Ophthalmol 2005; 123:1484–1498.
24. Arnold JJ, Sarks SH, Killingsworth MC, Sarks JP. Reticular pseudodrusen. A risk factor in age-related maculopathy. Retina. 1995;15(3):183-91.
25. Sarks J, Arnold J, Ho IV, Sarks S, Killingsworth M. Evolution of reticular pseudodrusen.Br J Ophthalmol 2011;95(7):979-85.
26. Suzuki M, Sato T, Spaide RF. Pseudodrusen subtypes as delineated by multimodal imaging of the fundus. Am J Ophthalmol. 2014;157(5):1005-12.
27. Ueda-Arakawa N, Ooto S, Tsujikawa A, Yamashiro K, Oishi A, Yoshimura N. Sensitivity and specificity of detecting reticular pseudodrusen in multimodal imaging in Japanese patients. Retina. 2013;33(3):490-7.
28. Querques G, Canouï-Poitrine F, Coscas F, et al. Analysis of progression of reticular pseudodrusen by spectral domain-optical coherence tomography. Invest Ophthalmol Vis Sci 2012;53(3):1264-70.
29. Smith RT, Sohrab MA, Busuioc M, Barile G. Reticular macular disease. Am J Ophthalmol 2009; 148:733–43.
30. Querques G, Canouï-Poitrine F, Coscas F, et al. Analysis of progression of reticular pseudodrusen by spectral domain-optical coherence tomography. Invest Ophthalmol Vis Sci. 2012;53(3):1264-70.
31. Meadway A, Wang X, Curcio CA, Zhang Y. Microstructure of subretinal drusenoid deposits revealed by adaptive optics imaging. Biomed Opt Express 2014;5(3):713-27.
32. Arnold JJ, Fraco MQ, Soubrane G, Sarks SH, Coscas G. Indocyanine green angiography of drusen. Am J Ophthalmol 1997; 124:344–56.






